|
Hat Darwin sich geirrt? Zur alleinigen Abstammung der
Haustaube von der Felsentaube
Molekulargentische Untersuchungen stellen viele Glaubensätze auch in
der Taubenzucht auf den Prüfstand. Eine wichtige Erkenntnis neuerer
Untersuchung zu den gehämmerten Zeichnungen bei Haustauben und zum
Stippergen und dessen Allelen war, dass Färbungen mit einer
strukturellen Veränderung des Erbgutes durch Veränderung der Anzahl
der Kopien von Segmenten der DNA (Copy Number Variation CNV) in
einem Genom verbunden waren (Vickrey u.a. 2018, Bruders u.a. 2020).
Nicht jede Abweichung vom Wild-Typ geht auf mutative Änderungen der
Basenfolgen in einem DNA-Abschnitt zurück. Das wurde, ausgehend von
Untersuchungen in der Humangenetik nach 2000, schon für andere
Tierarten untersucht. Die Erkenntnisse lassen aber auch in der
Taubenzucht vieles, was man bisher geglaubt hat, in neuem Licht
erscheinen. Eine andere im Zusammenhang mit der Untersuchung der
Zeichnungen abgeleitete These ist provokanter. Nämlich, dass die
Gene für die gehämmerten Zeichnungen von der Guineataube sehr
wahrscheinlich auf die Haustaube übertragen worden seien. Und zwar
in einer nur Jahrhunderte zurückliegenden Zeitspanne, und weit,
nachdem sich die Arten vor Millionen von Jahren getrennt hatten.
Darwin und die Tauben
Für Darwin stammen die verschiedenen Rasse der Haustaube alle allein
von der Felsentaube (C. livia) ab, von der er die Zeichnung eines
geschossenen Exemplars in seinem Werk ‚The variation of animals and
plant under domestication‘ (1868, 2nd. ed. 1875) abbildet. Die
wilden und halbwilden Tauben in den englischen ‚Dovecots‘ waren ein
typisches Zwischenglied der Domestikation. Das gelegentliche, und
nicht einmalige Auftreten gehämmerter Zeichnungen in sonst
blaubindigen wilden und halbwilden Populationen war für Darwin
(1868, 1875) eine Domestikationserscheinung. Die Abweichung der
Zeichnung war für ihn keine Rechtfertigung, Gehämmerte als Unterart
im Rang der etwas dunklere Felsentaubenvariante im indischen Raum
oder der etwas helleren Variante im Nilgebiet zu betrachten. In
einigen Regionen Englands waren halbwild gehaltene Gehämmerte so
verbreitet, dass Dixon diese 1851 in seinem Buch als typische ‚Dovecote-Pigeon‘
bezeichnet und abbildet. Zur Diskussion der zwischenzeitlich durch
Blyth C. affinis getauften gehämmerten Variante vgl. Darwin 1875
Vol. 1 Chapter VI.


Abb. 1: Die Felsentaube bei Darwin 1868/1875 und die gehämmerte ‚Dovecot-Taube‘
(Columba affinis von Blyth) bei Dixon 1851
Gehämmerte Tauben vor Darwin
Geht man zeitlich weiter zurück, findet man bei Albin eine mit 1735
datierte Zeichnung einer gehämmerten ‚Dovecot-Taube‘ mit dem Hinweis
auf die damals große Variationsbreite dieser halbwild gehaltenen
Tauben. Das zeigt sich hier schon in der Farbgebung des abgebildeten
Exemplars und im Text, wenn auf die Hämmerung bezogen von ‚Schwarz
mit aschgrauer Beimischung‘ (mixture with cinereous) geschrieben
wird. Aus heutiger Sicht künstlerische Freiheit oder schon ein
verdünntfarbenes gehämmertes Tier.

Abb. 2: The Common Dove House, or Wild Pigeon, datiert mit 1735.
Quelle: Albin, Natural History of Birds 1738 Vol III (Blatt 39)
In Thüringen hat Bechstein, der nicht nur Wissenschaftler, sondern
auch Taubenhalter war, an heimischen halbwild gehaltenen Beständen
beschrieben, wie im Prozess der Domestikation und der Anbindung an
den Menschen neue Färbungen entstanden (1795, 1807). Unter anderen
die ‚gedüpfelte‘ = gehämmerte Feldtaube.

Abb. 3: Zur Domestikation der Taube und Ausbildung von Varietäten,
Bechstein (1795), S. 18.
Bereits etwa 200 Jahre früher lässt Marcus zum Lamm um 1600
Feldflüchter (‚Feldratzen‘) malen, eine der Tauben zweifelsohne in
der gehämmerten Zeichnung. Er schreibt in seinen Notizen von
gehämmerten Tauben (ein Visch Schüppichte oder hammerschlegichte
Daub), zitiert bei Kintzenbach/Hölzinger 2000, S. 189.

Abb. 4: Feldtauben oder Feldt Ratzen bei Marcus zum Lamm um 1600 (Kintzenbach/Hölzinger
2000)
In dem von Friedrich II zwischen 1259 und 1266 geschriebenen und mit
Zeichnungen auch von Tauben illustrierten Falkenbuch ‚De arte
venandi cum avibus‘ wird unter Nutzung früherer Quellen auch die
übrige Vogelwelt dargestellt. Wenn die einzeln dargestellte Taube
die blaubindige Urform darstellen soll (fol. 18), dann dürfte es
sich bei den zusammen mit Wildtauben gezeigten Haustauben ebenfalls
schon um gehämmerte Abweichungen von der bindigen Zeichnung handeln
(fol. 11). Interessant eine noch frühere Abbildung aus der Zeit vor
Christie Geburt, abgedruckt im Buch von Daniel Haag-Wackernagel, die
als gehämmert interpretiert wird.
  
Abb. 5: Eine blaue Haustaube und Haustauben vergesellschaftet mit
Wildtauben im Falkenbuch Friedrich II 1241-1248, fol. 18 und fol.
11, Wandbemalung aus dem Grünen Zimmer des Nordpalastes von Tell el
Armana, Ägypten 1350 v. Chr. (abgedruckt bei Haag-Wackernagel 1989,
Sell 2009)
Evolution der Taubenarten
Goodwin hat für einige Gruppen von Taubenarten versucht
nachzuzeichnen, wann sich einzelne Gruppe und Arten, von einem
gemeinsamen Ursprung ausgehend, auf- und abgespalten haben.
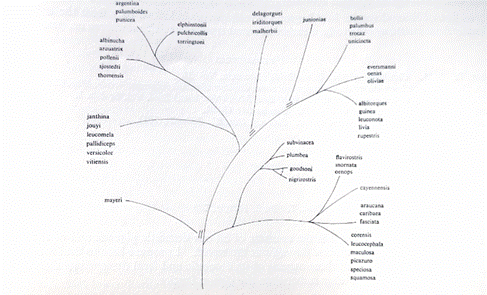
Abb. 6: Vermutete Beziehungen im Genus Columba bei Goodwin, Pigeons
and Doves of the World, second ed. London 1970, S. 53.
Die Felsentaube, und davon abgeleitet auch die Haustaube, wird als
C. livia als eng verwandt mit der Ampharentaube, der Schneetaube,
der Guineataube und der Klippentaube angesehen. Dieser Ast wird hier
gesondert aufgezeigt.
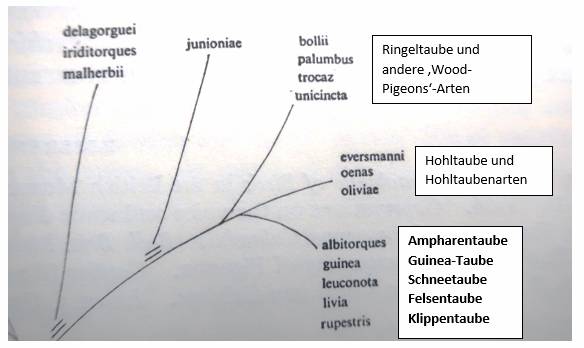
Abb. 7: Ausschnitt aus dem Schaubild über die Beziehungen im Genus
Columba bei Goodwin, Pigeons and Doves of the World, second ed.
London 1970, S. 53 mit deutschsprachigem Textzusatz
Die Wildformen von Taubenarten, deren Wege sich im Entwicklungsweg
früher getrennt haben, sind unterschiedlicher in Erscheinung und
Verhalten voneinander als Arten, bei denen das später passiert ist.
So haben nach dem Schaubild Ampharentaube, Guinea-Taube und
Klippentaube länger einen gemeinsamen Entwicklungspfad durchlaufen
als mit der Hohltaube und der noch davor abgespaltenen Ringeltaube.
Je länger die Ab- oder Aufspaltung zurückliegt, umso größer die
Wahrscheinlichkeit, dass sich durch unterschiedliche Mutationen in
den getrennten Gruppen, und durch Verlust vorher gemeinsamer Gene in
einer Population, Verhalten und Erscheinungsbild auch der Wild-Form
unterschiedlich entwickeln. Die genetische Ähnlichkeit von Arten und
die vermuteten Zeitspannen werden in einer molekulargenetischen
Untersuchung mit dem Versuch einer Klassenbildung enger verwandter
Arten von Soares u.a. 2016 dargestellt.
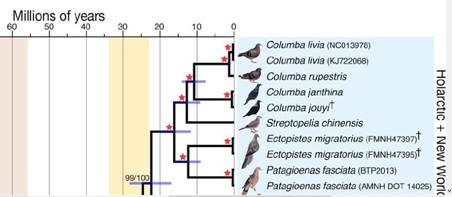
Abb. 8: Clustering von Wildtauben nach genetischer Ähnlichkeit nach
Soares u.a. 2016 (Ausschnitt)
Einbezogen in die Untersuchung sind auch bereits ausgestorbene
Arten. Die Guineataube war nicht dabei, auch nicht die Hohltaube und
die Ringeltaube. Bei den beiden Beispielen der Columba livia handelt
es sich, nach der Quellenangaben zu vermuten, um Gimpel als
Haustaubenrasse und Felsentauben mit geringer genetischer Distanz
dazu. Die nächstverwandte Art ist die Klippentaube C. rupestria, die
sich äußerlich bis auf die typische weiße Aufhellung vor der
Schwanzbinde als Abschluss kaum von der C. livia unterscheidet. In
der Liebhaberzucht ist das Merkmal bei Berner Spiegelschwänzen
verankert. Die Entfärbung der Schwanzfedern unterscheiden sich in
beiden Fällen äußerlich von den dunkler eingefassten Spiegeln
Orientalischer Mövchen. Ähnliche Ausbleichungen treten in
Kombination mit anderen Erbfaktoren in abgeschwächter Form auch bei
anderen Haustaubenrassen auf (vgl. dazu auch Bilder in Pigeon
Genetics 2012 und Genetik der Taubenfärbungen 2015), möglicherweise
ein gemeinsam bewahrtes Erbe einer gemeinsamen Vorform oder eine
frühe Introgression.
Introgression und ‚Retrogression‘ aus historischer Perspektive
Introgression, im Titel der zitierten Studie von 2018, bedeutet die
Übertragung von Genen nach Bildung und Festigung der
unterschiedlichen Arten von einer Art auf eine andere. Der Zeitraum
der Übertragung der gehämmerten Zeichnung von der C. guinea auf die
C. livia wird in der Studie nach den Modellrechnungen auf vor 429
bis 857 Jahren bei einer Generationenfolge von ein bis zwei
Generationen pro Jahr geschätzt (Vickrey et al. 2018, S. 12). Das
wäre, zurückgerechnet, um 1200 – 1600 n. Chr. Es ist die Zeit, in
der Friedrich II, Kaiser des römisch-deutschen Reiches, das
Falkenbuch ‚De arte
venandi cum avibus‘ schreibt (1258-1266) und in der Marcus
zum Lamm seine Notizen zum ‚Picturarum‘ verfasst und Bilder von
Haustauben und Feldtauben malen lässt (um 1600). Die Jahrhunderte
dazwischen waren in Europa durch die Pest im 14. Jahrhundert und
durch kriegerische Auseinandersetzungen geprägt. Ende des 15.
Jahrhunderts wurde Amerika von den Europäern entdeckt und nach 1600
verwüstete der 30-jährige Krieg viele Landstriche Europas. Die
Verbreitung der Guinea-Taube dürfte zu der Zeit nicht von der durch
Goodwin angegebenen Verbreitung abgewichen sein. Zu Überlappungen
der Verbreitung der Felsentaube und der Guineataube ist es in
einigen Teilen Afrikas gekommen. Dass in Europa um die Zeit bewusst
Kreuzungen mit Haustauben stattgefunden hätten, ist
unwahrscheinlich.
 
Abb. 9: Verbreitungskarten für die Felsentaube und die Guineataube
bei Goodwin (1970)
Von den historischen Umständen wurde angenommen, dass das
sporadische Erscheinen gehämmerter Varianten in weit voneinander
entfernten Teilen Mitteleuropas auf sich wiederholende Mutationen
zurückzuführen ist und nicht auf bewusste oder zufällige Kreuzungen
mit der Guineataube. Die gehämmerte Zeichnung ist dominant und kann
nicht, wie ein rezessives Gen, lange in einer Population verdeckt
vorhanden sein, bis sie sporadisch auftaucht. Die Beobachtung
Bechsteins (1795) des Entstehens aus wildfarbenen
Feldtaubenbeständen in Thüringen und das Auftreten an den Küsten
Englands und auf den Färöer und Orkney-Inseln, ganz im Norden des
Verbreitungsgebiets der Felsentaube (Darwin), lassen sich mit
Kreuzungen zwischen den Arten nur schwer in Einklang bringen.
Eine Zusammenfassung von Ergebnissen von Kreuzungen von
Wildtaubenunterarten untereinander findet sich bei Gray 1958. Die
Aufstellung, hier ein Ausschnitt, zeigt die Probleme, selbst unter
kontrollierten Bedingungen eine erste Generation zu erhalten.

Abb. 10: Bird Hybrids, Ausschnitt bei Annie P. Gray 1958, S. 128.
Über erfolgreiche Aufzucht von Hybriden bei Kreuzungen mit
Guineatauben wurde dennoch mehrfach berichtet. Dietmar Fennelt, der
Klippentauben nach Deutschland gebracht hatte, berichtete über
Vierfachkreuzungen mit Anteilen von Hohltauben, Felsentauben,
Guineatauben und Klippentauben, die eine durchgehend fruchtbare
Linie ergeben hätten (Mitteilungen in einem Internet-Blog und
pers.). Dass es gelungen ist, auch bei infertilen weiblichen
Hybriden aus Felsentaube x Guineataube von den männlichen Hybriden
Nachkommen zu erhalten und nach zweimaliger Rückpaarung von Täubern
an blaubindige C. livia auch fruchtbare Nachkommen (Vickrey et al.
2020, S. 10 mit Bezug auf Taibel, 1949), muss nicht bedeuten, dass
es auch in freier Natur so erfolgt und das Erbgut dauerhaft in die
Population eingeflossen wäre. So berichtete Stauber 2004 über eine
Introgression durch Kreuzungen von Berner Spiegelschwänzen, eine
Schweizer Farbentaube, mit Klippentauben.

Abb. 11: Berner Spiegelschwanz und Klippentaube (Quelle: Genetik der
Taubenfärbungen)

Abb. 12: F1 aus Spiegelschwanz und Klippentaube (Foto
Karl Stauber, abgedruckt in Sell, Taubenzucht, Achim 2019)
Unerwartet, wegen der großen Ähnlichkeit, gelang es zunächst nicht,
Jungtiere der ersten Generation aufzuziehen. Sie schienen eine
längere Versorgung mit Kropfmilch zu benötigen. Durch Rückpaarung an
Berner Spiegelschwänze wurden fruchtbare Nachkommen erzielt, die den
Spiegelschwanz der beiderseitigen Ausgangstiere vererbten. Von
Introgression in die Haustaubenpopulation zu reden, ist dennoch
übertrieben. Zum einen war der Spiegelschwanz schon vor den
Kreuzungen vorhanden. Die intermediäre erste Generation bei
Kreuzungen deutet eher auf parallele Entwicklungen bei diesem
Merkmal hin. Zum anderen sind die Berner Spiegelschwänze selbst eine
seltene Rasse, und Rassen und Linien verschwinden mit den Züchtern.
Potentiell durch Kreuzungen eingeflossene Gene können auch wieder
verloren gehen, es kommt zur ‚Regression‘.
Molekulargenetische Indizien
Für Untersuchungen, inwieweit und wann eine Introgression zwischen
zwei Arten stattgefunden hat, wird in jüngeren Untersuchungen die
D-Statistik herangezogen. Methodisch ähnelt das Vorgehen einem
geschickt gestalteten Chi-Quadrat-Test. Verglichen werden gehämmerte
und bindige C. livia mit Guinetauben und, als Referenz (in der
Terminologie der Methodik die ‚outgroup population‘), die
Ringeltaube (Wood Pigeon). Deren Genom dient quasi als Vertreter des
Genoms der Ursprungsart vor der Auf- bzw. Abspaltung. Alle aus der
Ursprungsrasse entstandenen einzelnen Arten besitzen im Erbgut Teile
der Ursprünge. In der weiteren Evolution haben sich in den davon
abgespaltenen neuen Arten im Laufe der Jahrtausende und teils
längeren Zeiträumen unterschiedliche neue Mutationen im Genom
durchgesetzt. Andere, ursprünglich vorhandene Erbanlagen sind
ersetzt worden. Das Erbgut hat sich gewandelt. Wenn gehämmerte und
bindige C. livia keine unterschiedlichen Arten darstellen, dann ist
zu erwarten, dass sie im Hinblick auf die Erbanlagen den gleichen
Anteil der Erbanlagen der ‚outgroup-population‘ besitzen. Vorhanden
sind Sequenzen von Chromosomen der bindigen C. livia (bezeichnet als
P1), der gehämmerten C. livia (P2), der C.
guinea, die auch die gehämmerte Zeichnung besitzt (P3),
und als ‚outgroup population‘ Sequenzen der Ringeltaube.
Nullhypothese ist, dass P1 und P2 von einer
gemeinsamen Ausgangsart abstammen und nach der Trennung keinen
Genzufluss von einer der ebenfalls abgespaltenen P3
erhalten haben. Die Alternativhypothese ist die einer Introgression
nach der Trennung der Arten, wodurch die Hämmerung hätte übertragen
werden können. Methodisch wird von der ABBA und BABA-Konfiguration
gesprochen. Betrachtet werden Bereiche des Genoms, in denen es
Überdeckungen bei den vier Populationen gibt. Die ABBA-Konfiguration
bezieht sich auf Bereiche, in der P1 das Outgroup-Allel
und P2 und P2 das erworbene Allel (derived
copy) haben.
Die Konfiguration BABA korrespondiert mit Bereichen, in denen P1
und P3 die erworbenen Allele besitzen und P2
das Outgroup-Allel (Durand et al.
S. 2240, und sich darauf beziehend, Vickrey et al., 2018, S. 10). In
der Formulierung bei Durand et al.: „For the ordered set {P1,
P2, P3, O}. we call the two allelic
configurations of interest „ABBA“ or „BABA.“ The pattern ABBA refers
to biallelic sites where P1 has the outgroup alle and P2
and P3 share the derived copy. The pattern BABA
corresponds to sites where P1 and P3 share the
derived allele and P2 has the outgroup allele”.
Empirisch wird in der D-Statistik gemessen, welche Konfiguration die
plausiblere ist, indem die Differenz in der gemessenen genetischen
Ähnlichkeit in der ABBA und BABA-Konfiguration ermittelt wird. Diese
wird durch die Summe der beiden Werte normiert (vgl. Durand et al.
S. 2240).
Vielleicht ist eine andere Vorstellung eingängiger. Gemessen werden
die Ähnlichkeiten
P1 O
+ P2 P3
bei einer potentiellen ABBA-Figuration, und P1 P3
+ P2 O bei einer alternativen BABA-Figuration.
Für die D-Statistik folgt
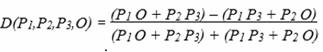
Wenn P1 und P2 keine
Introgression erfahren haben, dann werden sich die gemessenen
Ähnlichkeiten mit den anderen Populationen im Rahmen statistisch
nicht signifikanter Abweichungen bewegen. Die Ähnlichkeit P1
O wird der Ähnlichkeit P2 O entsprechen
(P1 O ≈ P2 O). Auch P2
P3 sowie P1 P3
werden sich entsprechen (P2 P3 ≈
P1 P3). Am Zähler ablesbar werde sich
die Summanden im Zähler weitgehend neutralisieren und die
D-Statistik wird sich null annähern. Größere Abweichungen davon
lassen sich als Indikator für Introgression interpretieren.
Die Hypothese glauben die Autoren in den Stichproben mit positiven D-Statistik-Werten nahe
null für eine Betrachtung des Gesamtgenoms auch bestätigt zu sehen (Vickrey
et al., S. 12, 17). Tests für die Kandidatengeneration, in denen die
Anlagen für die Zeichnungen und auch die Hämmerung liegen, zeigten
es deutlich (S. 12). Die Hypothese war, dass bindige
und gehämmerte C. livia sich ähnlicher sind als C. guinea.
Gefunden wurde in der ‚Kandidatenregion‘ für die Zeichnungen, dass
dort die gehämmerten C. livia der C. guinea-Taube deutlich ähnlicher waren
als den bindigen C. livia. Die Kandidatenregion scheint nach den
hohen D-Statistic-Werten wesentlich die für die Hämmerung
verantwortlichen Genombereiche zu umfassen. Die Bereiche scheinen
auch nicht groß genug, um im größeren Umfang durch Koppelungsbrüche
und Austausch von nicht direkt für die Hämmerung verantwortlichen
Faktoren durchmischt zu werden. Der für die Hämmerung relevante
Bereich bei der Guinea-Taube wies im Gegensatz zur Haustaube keine
Multiple Copy Variation (MCV) auf (S. 12). Das könnte auch ein Indiz
für die Notwendigkeit anderer Erklärungen sein, die im Folgenden
angedeutet werden.
Über den Test hinausgehende Betrachtung
Gleich erscheinende Merkmale wie bei der C. livia findet man auch
bei Unterarten der Turteltaube (genus Streptopelia) wie der
domestizierten Barbary-Taube (Streptopelia ‚risoria‘).
Es gibt Weiße mit dunklen Augen, Albinos mit pinkfarbenen Augen,
seidenfiedrige und solche mit anderen vom Normalen abweichenden
Federstrukturen (Goodwin 1970, S. 129). Über Nachkommen aus
Paarungen der Turteltaube mit C. livia berichtet auch Gray 1958.
James Demro zog ein spitzkappiges Jungtier aus einem spitzkappigen
Satinettentäuber mit einer spitzkappigen Wildtaube (Miller/Demro
2011). Da es sich bei der Spitzkappe um ein rezessives Merkmal
handelt, wurde zunächst von Allelen gesprochen.
 
Abb. 13: Kreuzung von Satinette (Haustaube) x Ring-Neck Pigeon mit
spitzkappigem Jungtier. Quelle: Miller/Demro 2011.
Spätere molekulargenetische Analyse einer Forschungsgruppe der
Universität Utah (Vickrey et al. 2015) zeigten, auch anhand dieses
Tieres, dass sich die Mutation bei der Wildtaube nicht direkt an
derselben Stelle im Genom befand, an der man es anhand der Lage bei
der Felsentaube vermutet hatte. Beide Mutationen lösen dennoch in
den jeweiligen Arten ähnliche biochemische Prozesse aus und erfüllen
damit ähnliche Funktionen (Vikrey et al., 2015, S. 2659ff.). Beide
Merkmale sind in ihrem jeweiligen Umfeld rezessiv, interagieren bei
der dargestellen Kreuzung aber wie Allele, so dass sich das Merkmal
im Hybrid zeigt. Für die Federhaube in unterschiedlichen
Haustaubenrassen war die Forschergruppe in früheren Untersuchungen
zum Schluss gekommen, dass es wahrscheinlich mutativ zu einem sehr
lange zurückliegenden Zeitpunkt zu einer Mutation gekommen ist.
Diese hätte sich durch Kreuzungen auf die unterschiedlichen
Rassegruppen verbreitet (Shapiro et al. 2013), wofür es zumindest
für das letzte Jahrtausend in der Haustaubenliteratur auch viele
Hinweise gibt. Die Frage bleibt dennoch, ob es bei den Taubenartigen
durch die gemeinsame Herkunft einen bias für Mutationen in dem
relevanten Genombereich gibt und so etwas wie ein ihnen gemeinsames
Entwicklungsprogramm, hier für die Haube, existiert. Das wird in der
Studie von 2015 (S. 2661f.) thematisiert und könnte analog auch für
andere Erscheinungen gelten, auch für die Hämmerung. Das würde das
Kriterium der D-Statistik zur Ermittlung von Introgressionen,
angewendet auf sehr enge Genombereiche, in Frage stellen. Das könnte
auch hier die auffallend hohen Werte der D-Statistik erklären. Die
angesprochene Möglichkeit scheint nicht einmalig in der Tierwelt,
wie umfangreiche Untersuchungen bei Buntbarschen gezeigt haben. Das
genetische Umfeld könnte bei sich auseinanderentwickelnden Arten in
bestimmten Bereichen ähnlich bleiben, ohne dass sich zunächst ein
bestimmten Merkmal zeigt. In Nachfolgearten könnte es parallel durch
selektive auslösende Mutationen aktiviert werden, das Merkmal käme
ohne Introgression zur Ausprägung. So wurde z.B. für Buntbarsche
gefunden, dass parallele Evolutionen schnell erfolgen und bestimmte
Merkmale unabhängig voneinander in verschiedenen Populationen
fixiert wurden (Urban et al. 2020, S. 466).
Interessant unter dem Gesichtspunkt, mehr Erfahrungen über ähnliche
Erscheinungen zu gewinnen und mögliche gleichartige Wirkungsketten
zu gewinnen, auch das oben bereits angesprochene Verhältnis der C.
livia zur Klippentaube. Das Merkmal des Spiegelschwanzes findet man,
wie die Hämmerung, sowohl bei Haus- als auch bei der Wildtaube. Die
Aufhellung zeigt sich nicht nur bei Berner Spiegelschwänzen, sondern
auch bei anderen Haustaubenrassen. So im Bild bei einer
Frosty-Variante und einem Türkischen Takla-Tümmler.
Molekulargenetische Untersuchungen speziell zum Spiegelschwanz und
möglichen Parallelen zwischen Haus- und Klippentaube scheinen nicht
vorzuliegen. Auch, ob es sich genetisch um identische Erscheinungen
bei Berner Spiegelschwänzen und anderen Rassen handelt, ist bisher
nicht untersucht.
  
Abb. 14: Aufhellungen vor der Schwanzbinde bei Haustauben und der
Klippentaube
Auch weitere Untersuchungen von Erscheinungen, die in sehr ähnlicher
Weise bei der domestizierten Felsentaube und Barbary-Taube
auftreten, könnten das Wissen über zugrundeliegende Mechanismen
erweitern.
Resumée
Eine der Gewissheiten, die man aus der Lektüre Darwins glaubt
mitgenommen zu haben, ist die, dass die Haustaube allein von der
Felsentaube abstammt. Molekulargenetische Studien, die zu dem
Ergebnis kommen, dass die Tauben in der heute weit verbreiteten
gehämmerten Zeichnung das Erbgut einer anderen Art, der ebenfalls
gehämmerte C. guina, tragen sollen, sind überraschend. Angeführt
werden hier Indizien, die das unwahrscheinlich erscheinen lassen. Es
sind die unterschiedlichen Verbreitungsgebiete der beiden Arten und
die Probleme, fruchtbare Hybriden aus Kreuzungen der Arten zu
bekommen. Dazu kommen die geschätzte Zeitspanne, in der eine
Introgression nach den Berechnungen stattgefunden haben soll, und
Berichte über Beobachtungen, die ein mutatives Auftreten der
gehämmerten Zeichnung, neben anderen Veränderungen, bei
domestizierten oder halbwild gehaltenen Feldtauben anstelle einer
Einführung durch Hybridisierung nahelegen. Die D-Statistikwerte der
molekulargenetischen Analyse, die auf eine Introgression hinweisen,
zeigen sich selektiv in der ‚Kandidatenregion‘ des Genoms, in der
sich die Hämmerungsanlagen befinden.
Möglicherweise gibt es dafür auch andere Erklärungen, wie sich
unabhängig voneinander wiederholende Mutationen. Diese könnten durch
ein ähnliches genetisches Umfeld begünstigt werden, das von on einem
gemeinsamen Vorfahren übernommenen wurde. Indikatoren für solche
Wirkungen gibt es. Lehrreich wäre es zu wissen, welche Ergebnisse
eine methodisch gleich aufgemachte Studie ergibt, wenn man die
Methodik der Studie auf die domestizierte Barbary-Taube (Streptopelia
‚risoria‘) und die dort vorhandenen rezessiv Weißen, Albino und
Seidenfiedrigen in einer ähnlich engen Sequenz anwendet.
Literatur:
Albin, Eleazar, Natural History of Birds.
Illustrated With a
Hundred and one Copper Plates, Engraven from the Life, Published by
the Author and carefully colour’d by his Daughter and Himself, from
the Originals, drawn from the live Birds, Vol III London MDCCXXXVIII
(1738)
Bechstein, Johann Matthäus, Gemeinnützige Naturgeschichte
Deutschlands nach allen drey Reichen, 4. Band Leipzig 1795
Bechstein, Johann Matthäus, Gemeinnützige
Naturgeschichte Deutschlands nach allen drey Reichen. Ein Handbuch
zur deutlichern und vollständigern Selbstbelehrung besonders für
Forstmänner, Jugendlehrern und Oekonomen, Dritter Band, Mit
Kupfern, Zweite vermehrte und verbesserte Auflage, Leipzig 1807
Bruders, R. u.a., (2020) A copy
number variant is associated with a spectrum of pigmentation
patterns in the rock pigeon (Columba livia). PLOS Genetics
16(5):1008274.
https://doi.org/10.1371/journal.pgen.1008274
Darwin, C. R., The variation of animals and plants under
domestication. London, John Murray. 2d edition. Volume 1, 1875
Dixon, E.S., The Dovecote and the Aviary, London 1851
Durand, Eric et al., Testing for Ancient Admixture between Closely
Related Populations, Mol.
Biol. Evol. 28(8):2239-2252, 2011
Fennelt, Dietmar, Forum Flügelvieh.de – Über Kreuzungen von
Wildtaubenarten http://forum.fluegelvieh.de/showthread.php?tid=238
Friedrich II, De arte
venandi cum avibus, Vatikan,
Biblioteca Apostolica Vaticana, Pal. lat. 1071 Friedrich <II.,
Heiliges Römisches Reich, Kaiser> Heidelberger historische Bestände
digital. Über die Kunst mit Vögeln zu jagen — Süditalien, 1258-1266;
Das Falkenbuch Kaiser Friedrich II. Nach der Prachthandschrift in
der Vatikanischen Bibliothek. Einführung und Erläuterungen von Carl
Arnold Willemsen, Harenberg.
Dortmund 1980
Goodwin, Derek, Pigeons and Doves of the World, British Museum
(Natural History), 2nd edition London 1970
Gray, Annie P., Birds Hybrids, A Check-List with Bibliographie,
Bucks, England 1958
Haag-Wackernagel, Daniel, Die Taube. Vom heiligen Vogel der
Liebesgöttin zur Straßentaube, Basel 1998
Kinzelbach, Ragnar K. und Jochen Hölzinger (Hrsg.), Markus zum Lamm,
Die Vogelbilder aus dem Thesaurum Picturarum, Ulmer: Stuttgart 2000
Miller, W.J. und J.R. Demro, Allelism of Crested Traits in Columba
Livia and Streptopelia Risoria, Iowa State Pigeon Assoc Bull. 2011,
S. 6-7
Raethel, H.-S., Wildtauben. Exotische Ziervögel, Ulmer: Stuttgart
1980
Sell, Axel, Critical Issues in Pigeon Breeding. What we know and
what we believe to know. Anecdotal, Entertaining, and Educational
comments on open questions Part 1, Achim 2020.
Sell, Axel, Genetik der Taubenfärbungen, Achim 2015
Sell, Axel, Pigeon Genetics. Applied Genetics in the Domestic Pigeon
Sell, Axel, Tauben. Züchten mit System, Reutlingen 1995
Sell, Axel, Taubenrassen. Entstehung, Herkunft, Verwandtschaften.
Faszination Tauben durch die Jahrhunderte, Achim 2009
Shapiro, Michael D., Genomic diversity and evolution of the head
crest in the rock pigeon, Science 2013 Mar 1, 339(6123): 1063-1067
Soares, André E.R. et al., Complete mitochondrial genomes of living
and extinct pigeons revise the timing of the columbiform radiation,
BMC Evolutionary Biology 2016
Stauber, Karl, Von Berner Spiegelschwänzen und spiegelschwänzigen
Klippentauben, Geflügel-Börse 8/2004, S. 14-16
Urban, Sabine, et al., Different Sources of Allelic Variation Drove
Repeated Color Pattern Divergence in Cichlid Fishes (University of
Konstanz), Mol. Biol. Evol. 38(2): 465-477 Advance Access
publication September 17, 2020
Vickrey, A. et al., Convergent Evolution of Head Crests in Two
Domesticated Columbids Is Associated with Different Missense
Mutations in EphB2, Mol. Biol. Evol. 2015
Vickrey, Anna I, E.T. Domyan u.a., Convergent Evolution of Head
Crests in Two Domesticated Columbids Is Associated with Different
Missense Mutations in EphB2, Oxford Journals. Molecular Biology and
Evolution 2015 June 23
Vickrey, Anna I. et al., Introgression of regulatory alleles and a
missense coding mutation drive plumage pattern diversity in the rock
pigeon, eLifesciences.org 2018
A.S.
|